bázispár/ Humán genom (haploid)
GRCh38.p13
bázispár/ Humán genom (haploid)
GRCh38.p13
Fehérjét kódoló humán gén
(2020. 03. 28.)
Betegség-asszociált humán gén
(2020. 03. 28.)
Sejt az emberi szervezetben

AZ ÖRÖKÍTŐANYAG EGYSÉGÉNEK TEKINTENDŐ SPECIFIKUS nukleinsav SZEKVENCIA, AMELY FUNKCIÓVAL RENDELKEZŐ MOLEKULÁT KÓDOL.
A Humán Gén Nómenklatúra Szervezet (HGNC) irányelve alapján a gén meghatározásához továbbá az is hozzátartozik, hogy a gén hozzájárul a sejt fenotípushoz vagy funkcióhoz.
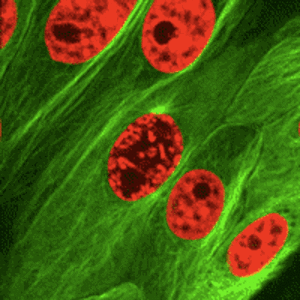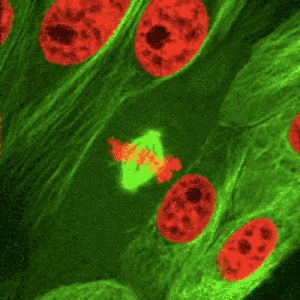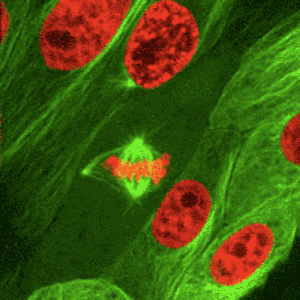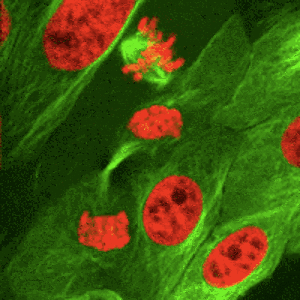
Az osztódó testi sejtekre jellemző, ún. számmegtartó osztódás. A mitózis során az interfázisban megkettőzödött DNS és további sejtalkotók szétosztását jelenti, a mitózis folyamata az utódsejtek kialakulásában teljesül ki.
A DNS molekula alapvető tulajdonsága, az interfázis S fázisában, a DNS molekula megkettőződési folyamatát foglalja magába. A folyamat szemikonzervatív, a keletkezett két DNS molekulának egy-egy szála újonnan szintetizálódott, a másik szál pedig az eredeti, templát DNS szál.
Az ivarsejtekre jellemző osztódás, a folyamat során a kromoszómaszám megfeleződik, azaz haploid sejtek alakulnak ki. Ugyanakkor, a meiózis alatt történik a homológ kromoszómák (kromoszómapárok tagjai) között a genetikai rekombináció, amely az új génkombinációk létrehozásának egyik fő mechanizmusa. A homológ kromoszómák párba állását követően a DNS molekulák több 100 kettőstörést szenvednek. Átlagosan 97-98 kettőstörés javítódik, a hátramaradt 1-3 rész részt vesz az ún. kromoszóma szinapszisban. A folyamat eredményeként új génkombinációk születnek. Férfiakban pubertásban kezdődik a spermatogenézis (hím ivarsejt generálás és érés), mely eredményeként megtermékenyítésre képes spermiumsejtek jönnek létre. Nőkben már az embrionális korban kezdetét veszi az oogenézis (petesejtképződés és érési folyamat) és pubertáskortól kezdődően havonta 1 petesejt fejezi be az érési folyamtát.
A DNS molekulákban tárolt információk kifejeződésének folyamatát nevezzük génexpressziónak. A hírvivő RNS molekulákat kódoló gének érési folyamatokon esnek át a sejtmagban, majd a citoplazmába kerülve döntő részük fehérjékké transzlálódik. A 18-21 nukleotid hosszú ún. mikro RNS molekulák (miRNS) hasonlóan érési folyamatot követően befolyásolják a génexpressziót azáltal, hogy a teljesen, vagy részlegesen komplementer mRNS molekulához kötődve indukálják az mRNS molekula lebontását vagy gátolják az mRNS molekula transzlációját.
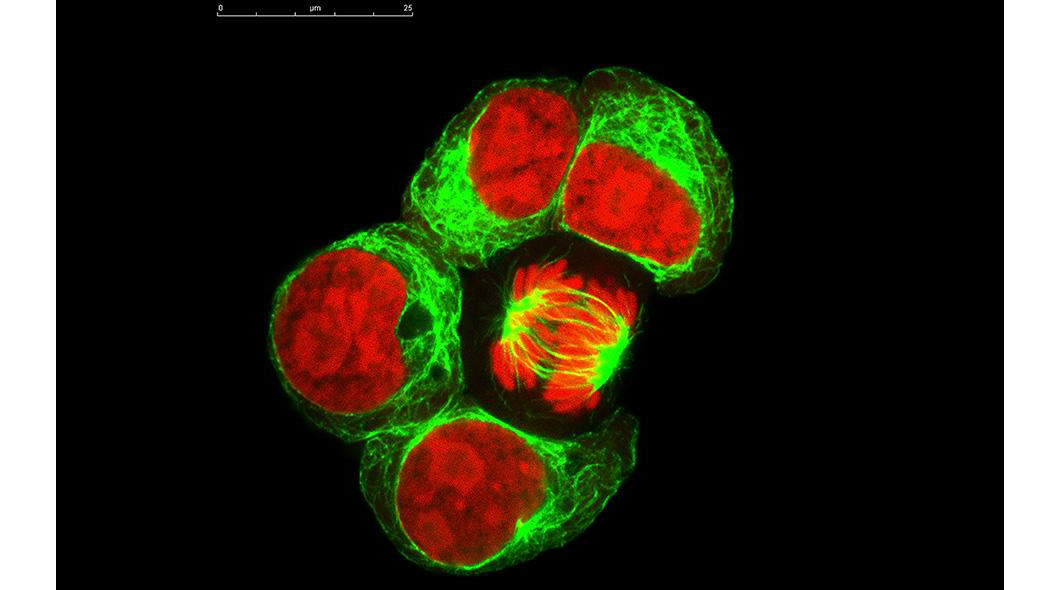
A genetikai információ átadása egy szervezeten belül sejtről-sejtre a sejtciklus során adódik át. Egy adott szomatikus sejt osztódása során két, genetikailag azonos sejt keletkezik. A sejtciklus két fázisra osztható: Interfázisra és M fázisra. Az interfázis a sejtosztódás közötti idővonalat foglalja magába. Három szakaszra ostható: 1. G1 - preduplikációs szakasz, 2. S - DNS szintézis szakasz, 3. G2 - posztduplikációs fázis. Az M fázis a sejtosztódás szakasza.
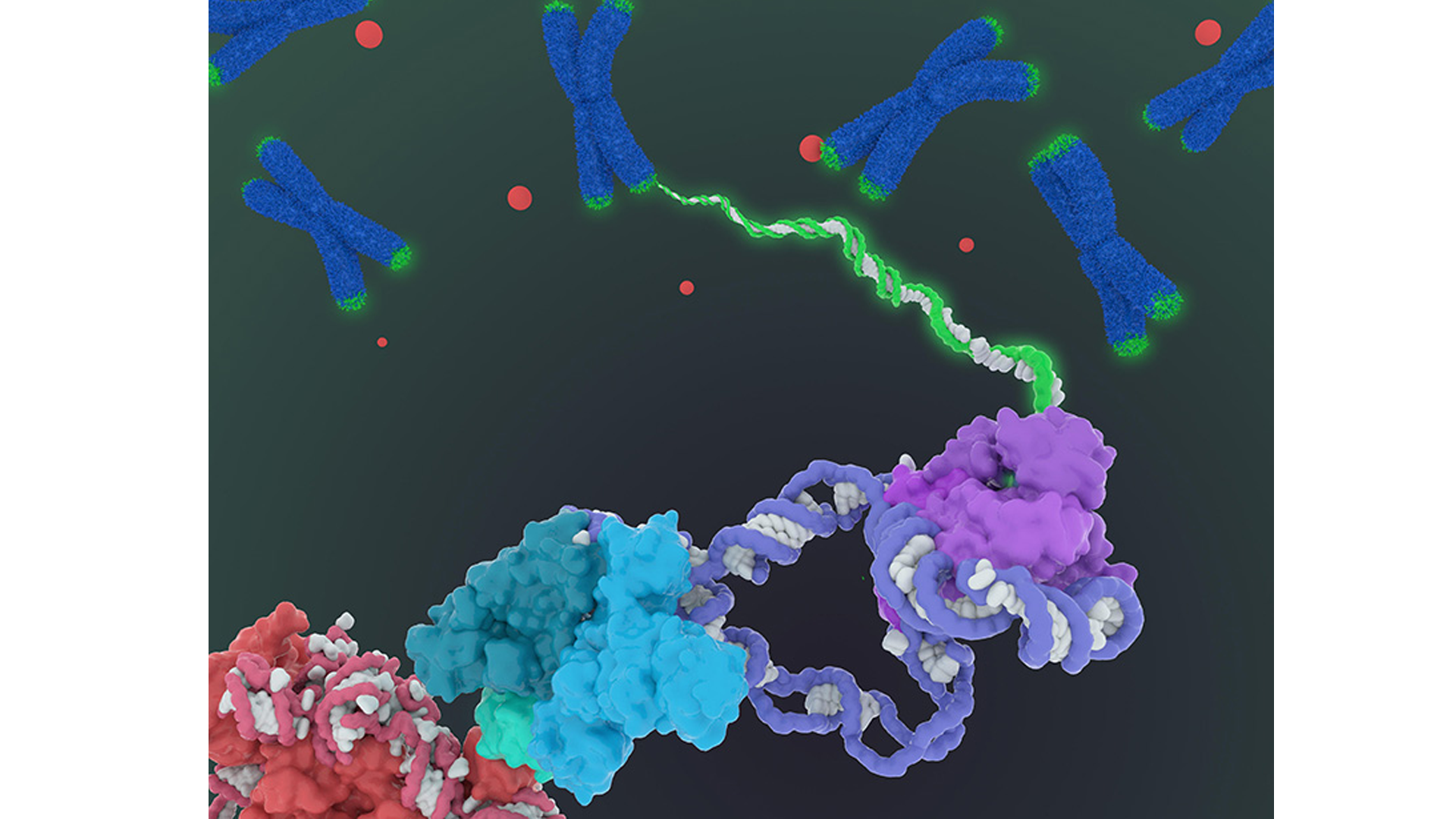
A DNS molekula megkettőződési folyamata során helytelenül beépülő nukleotidok jelentik a replikációs hibát. A replikációs hibák gyakorisága 1:100000000. Amennyiben bekövetkezik a replikációs hiba, 99%-os eséllyel a DNS hibajavító enzimek korrigálják. A nem korrigált replikációs hibák genommutációt okoznak. Fenotípusos következménnyel leginkább akkor számolhatunk ha a replikációs hiba egy gént kódoló DNS szekvenciában jött létre.
A citogenetika elsősorban a sejtekben található kromoszómák számbeli és strukturális elváltozásait vizsgálja. Továbbá ún. DNS szondák segítségével tetszőleges specifikus DNS szekvencia jelenléte vagy kópiaszáma is meghatározható. A vizsgálat sokszor szerves részét képezi a klinikai genetikai vizsgálatsorozatnak. A legtöbb esetben perifériás vérmintából történik az analízis, leggyakrabban örökletes betegség/ szindróma diagnózisának kapcsán vagy családtervezést megelőzően. Továbbá prenatális (vagy preimplantációs) vizsgálatok esetén magzatvíz, chorionbiopsziából (vagy morulából) történik a vizsgálat. Tumorsejtek változatosságának és mutációs terhének vizsgálatára is alkalmazható, ez esetben természetesen a tumorszövet képezi a vizsgálandó mintát.
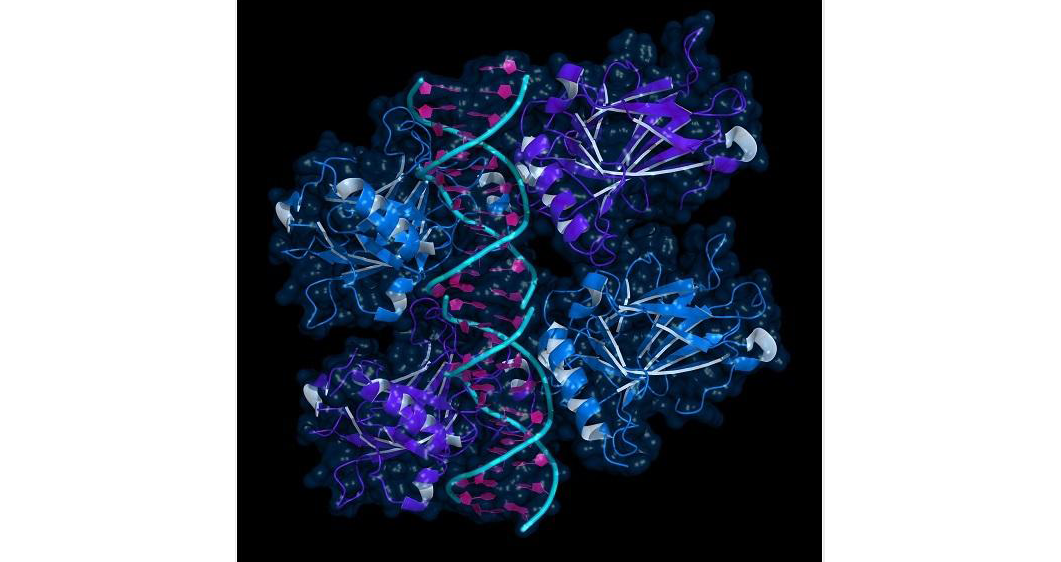
A hiszton fehérjék (H1, H2A, H2B, H3, H4 és ezek további izoformáik) jellegzetesen a sejtmagban találhatók és döntő szerepet játszanak a DNS szerkezetének a kialakításában és a génexpresszió szabályozásában azáltal, hogy a különböző kémiai változtatások (hiszton metiláció, acetiláció, ubikvitináció) révén nyitottá vagy zárttá tesznek bizonyos kromatin régiókat.
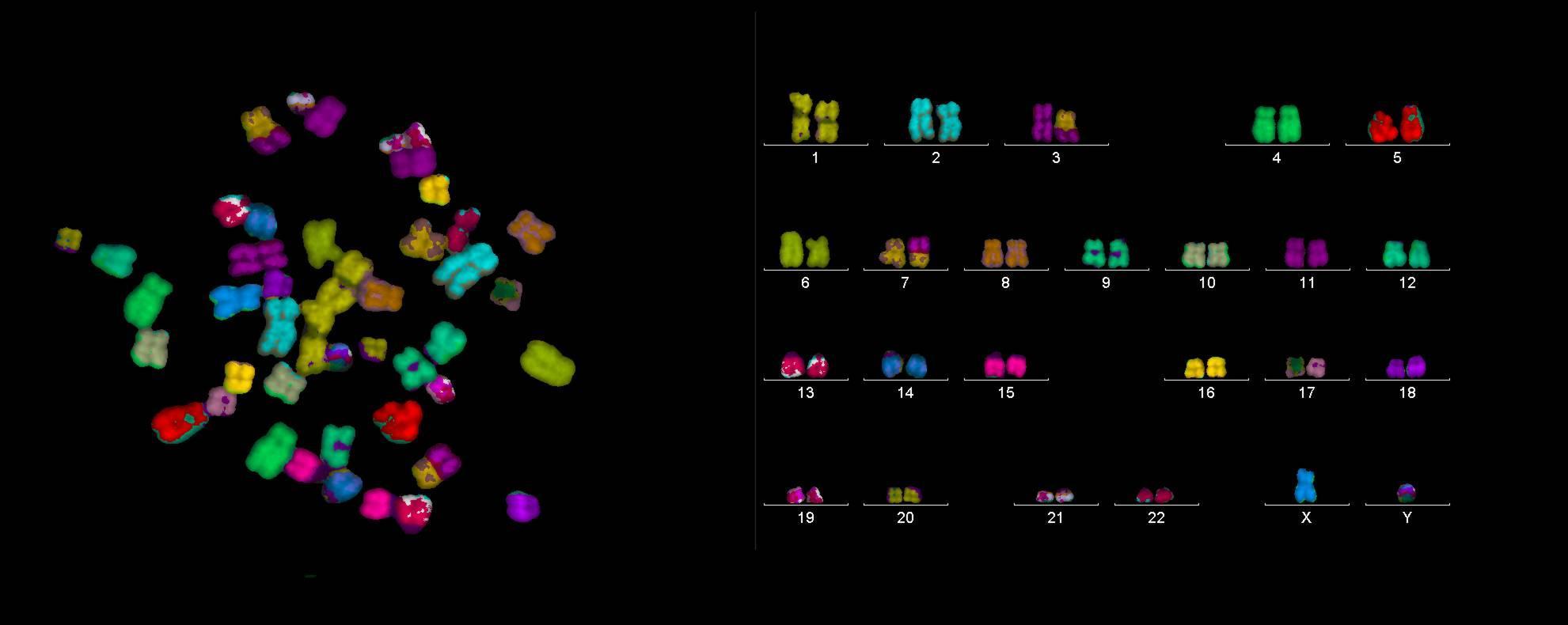
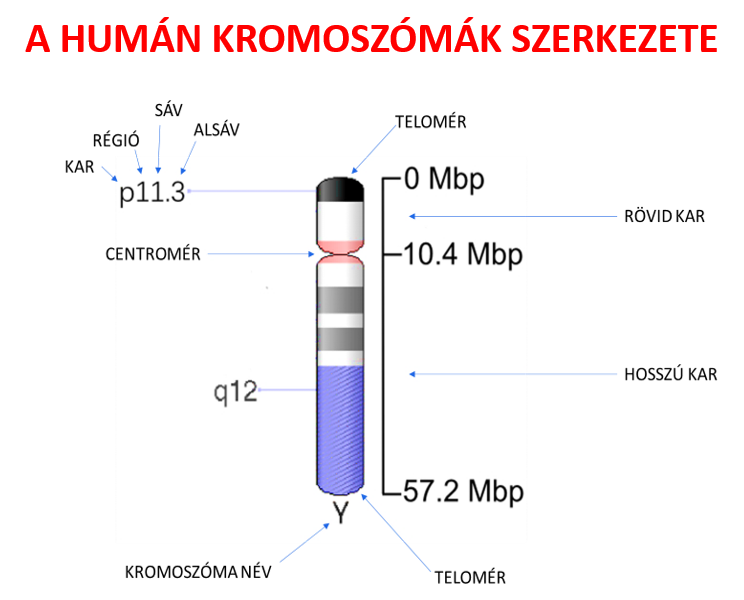
A kromoszómák státuszának azonosítása érdekében ún. sávozási technikákat alkalmaznak (G-sávozás, R-sávozás, T-sávozás, C-sávozás). A sávmintázat alapján a kromoszómák centromér régióitól kiindulva arab számokkal régiókra, sávokra és alsávokra oszthatók. Mai felbontási technikák 1-3 megabázispár hosszú szakaszok azonosítását teszik lehetővé, így megközelítőleg 850-1000 sáv elkülönítésére adnak lehetőséget. Eredményül kapott sávmintázatot citogenetikai térképnek nevezzük. Minden gén lokusza hozzárendelhető egy citogenetikai lokuszhoz (SQSTM1 gén lókusza 5q35.3).

Tipikusan a gén kódoló régióját megelőző DNS szekvencia, amely tartalmazza az RNS polimeráz kötőhelyét, illetve további szabályozó fehérje kötőhelyét.
A DNS helyes másodlagos szerkezetét 1953-ban fedezték fel. A másodlagos szerkezet a tulajdonképpeni DNS hélixet jelenti, melyben az egyes nukleotid molekulák komplementaritás alapján kettős vagy hármas hidrogénhíd kötéseket alakítanak ki egymással (Kettős: Adenin=Timin, hármas: Guanin≡Citozin). Fokozatosan változó átmérőjű spirált alkot egymással az egymással komplementer két DNS szál.
A restrikciós endunkleázokat baktériumokból izolálták (megtalálhatók egyes vírusokban is), ezen enzimek a DNS molekulában egy 4-8 bázispár hosszú jellegzetes szekvenciát ismernek fel. A felismert helyeken a DNS mindkét szálát átvágva hasítják a DNS molekulát (foszfodiészter kötések hasítása révén). Felhasználhatók pontmutációk és allélvariánsok kimutatásában, illetve génklónozás kapcsán a gének inszerciójában plazmid vektorokba.
A DNS negyedleges szerkezetének tekinhetők a kromoszómák. Ez a DNS legkondenzáltabb formája, amely a sejtciklus metafázis szakaszában a legkifejezetebb. A humán kromoszómák szerkezetük alapján három csoportba sorolhatók: metacentrikus (1, 2, 3, 16, 19 és 20 kromoszóma), szubmetacentrikus (4, 5, 6, 7, 8, 9, 10, 11, 12, 17, 18 és X) és telocentrikus(13,14,15, 21, 22 és Y).






Az élet molekulája, a dezoxiribonukleinsav (DNS), az egyik legstabilabb molekula, féléletideje megközelítőleg 521 év. Minden sejt működését irányító stabil kódrendszer, amely generációról generációra átadódik, folyamatos fejlődésre képes szenzációs egység. A genom magába foglalja a teljes DNS készletet, azaz tartalmazza mindazon információt, amely szükséges a szervezet felépítéséhez és fenntartásához.
A képen látható a sejtmagban elhelyezkedő 23 pár kromoszóma leghűbb és aktualizált modellje, melyet Steven és mtsai publikált 2017.03.13-án a Nature újságban (doi:10.1038/nature21429).
1990-ben indult az emberiség egyik legnagyobb méretű orvosbiológiai kutatása. A projekt célja a humán genom szekvenciájának a feltárása volt. 2001. február 15-én a Nature és Science folyóiratokban közölték az eredményeket, majd 2003. április 14.-én befejezettnek minősítették.

Az ember legalapvetőbb biológiai meghatározója az egyes sejtjeiben található örökítőanyag. A korszerű nézet egyértelműen alátámasztani hívatott az örökítőanyag képlékenységét. Az idő- és térdimenzió hatása igen nagy jelentőséggel befolyásolja a bennünk élő örökítőanyag szerkezetét és funkcionalitását. Ezen szorosan szabályozott rendszer működési protokollját a környezeti tényezők felülírhatják és olykor felül is írják. A létrejövő igen komplex interakció eredményeként alakul ki a fenotípus: az egészséges szervezet vagy bölcsőjét veszi egy kóros folyamatlánc, mely végsősoron gyakran életminőségcsökkentő betegséget eredményez. A genom működésének legújabb tudományos alapokon nyugvó elméletének izgalmas felderítő kalandjára hívom meg Önt.
Mielőtt belevághatnánk a sejtvezérlő élő molekulaközpontba, tekintsük át azokat a fogalmakat, amelyek biztosítják közös utazásunk során a közös nyelvet - a gördülékeny úthoz szükséges mankók - a bennünk rejlő csodálatos örökítőanyag megismeréséhez.
A genomika fogalmát megelőző és hosszú évtizedeken át domináló fogalom az öröklődéstan homlokterében a genetika volt. 1906-ban William Bateson a III. Londoni Növényhibridizációs konferencián vezette be a genetika fogalmát. Míg a genetika az egyes génekhez vagy dezoxiribonukleinsav (DNS) szakaszokhoz köthető funkciókat vizsgálja, a genomika a teljes genom szintjén, hálózatban próbálja értelmezni, átláthatóan örökítőanyagunk sorsmeghatározó voltát. Az 1930-as évek során született a genom, mint fogalom, a gén és kromoszóma szavak keverékeként. A genom jelentése az egy-sejtben található, fajra jellemző, DNS mennyiség, melynek szerves részét képezik a gének. A gén időszerű meghatározása, pedig a DNS egy olyan funkcionális szakasza, amelyről ribonukleinsav (RNS) molekula íródhat át. A humán sejtekben 23 pár DNS molekula található, melyek a sejtosztódási folyamathoz szükséges erős feltekeredésen (úgynevezett kondenzálódáson) esnek át, kromoszómákat (festődő testecskék) alkotva. A 2000-es éveket követően a tudományos világban robbanásszerű eredmények kapcsán megszületett a funkcionális genomika fogalma. A funkcionális genomika egy átfogó fogalom, amely magába foglalja a genom és a genomról folyamatosan képződő (RNS-re átíródó és fehérjékre szintetizálódó, azaz transzlálódó) molekulák összjátékát, melyek meghatározzák a sejtélettani folyamatokat. A genomról képződő összes RNS molekulák mennyiségét nevezzük transzkriptomnak. További részfogalma a funkcionális genomikának a hiszton kód. A DNS molekulák szinte kizárólagosan, valamilyen szinten felcsavarodott állapotban vannak. Ezen állapot kulcsszereplői a hiszton fehérjék, amelyek a genom működésének egyik fő szabályozórendszerét képezik. A hiszton kód a teljes hiszton fehérjemintázat egyes specifikus kémiai módosításainak a jellemzését foglalja magában. Végül, de nem utolsó sorban a DNS metilációs kód a DNS molekulák speciális szakaszain kialakult metilációs csoportok mintázatának meghatározását jelenti. A funkcionális genomikához tartozik részben az epigenomika. Szó szerint az epigenomika a „genom felettit” jelenti. Mindazon környezeti faktorokat vizsgáló tudományág amelyek a genom működését, annak DNS szekvencia módosítása nélkül, megváltoztatja. Következetésképpen a DNS metilációs kód és a hiszton kód az epigenomika két alappillérét alkotja. 2009-ben Tang és mtsai publikálták a világ első egy-sejt transzkriptomikás módszertant. 2012-ben Jinek és mtsai felfedezték, hogy a Streptococcus pyogenes baktérium bakteriális immunrendszeréhez tartozó (II-es típusú CRISPR-Cas rendszer) felhasználható génsebészeti eljárásként, amely igen meghatározó mérföldkőnek számít a tudományterületen. A tudományterület legifjabb ága, amely lehetővé teszi a genom, epigenom, transzkriptomika és proteomika egyidejű vizsgálatát, az egy-sejt funkcionális genomika 2017 második felében fejlődött alkalmazható módszertanná. Egy átláthatóbb, genetikai logikai szálakat összefűző útvonaltérképezést jelent egy-sejt szintű funkcionális genomika.


Az emberiség történelemkönyvét lapozgatva számos olyan utalást és észrevételt olvashatunk, bizonyos élettani jelenségekről, amelyek az öröklődéstant, mint tudományág bölcsőjét alapozták meg. Már az ókorban is megfigyelték, hogy fontos a lovak tenyésztésében a kanca tulajdonságait nyomonkövetni. Hasonlóképpen számos háziállat esetében is erre vontakozó megfigyelésekkel találkozhatunk. De nemcsak az állatok esetében, hanem a növénynemesítés kapcsán is alkalmazták a különböző észrevételeket, például a vetőmagnak szánt gabona válogatási szempontja volt, hogy minél nagyobb legyen. Hippokratész szerint az egyes tulajdonságok öröklődnek, az utódok a szülőktől öröklik, ezzel szemben Arisztotelész úgy vélte az utódok távolabbi őseikre hasonlítanak. Először a 18. században növényekkel kísérletezett, növény hibridekkel foglakozott Kölreuter (1761-1766 között). Az első emberi betegség örökletességére született megfigyelés 1752-ben történt: Maupertuis megfigyelte a polydaktylia domináns öröklődését.
Gróf Festetics Imre (1764-1847) volt az első ember aki először használta a "genetika" fogalmat egy tudományos cikkben (Die genetische Gesätze der Natur. Oekonomische Neuigkeiten und Verhandlungen,1819) a világon, ezzel megelőzve a genetika, mint tudományágnak hivatalosan elfogadott névadóját William Batesont 80 évvel. Festetics elsőként utalt a "természet genetikai tövényeire". Megfogalmazta Mendel II. törvényét, illetve a mutáció alapelvét.
 Gróf Festetics Imre
Továbbá 1820-ban Nasse megállapította, hogy a vérzékenység anyáról a fiú utódra öröklődik. A genetika atyjának tekintett Johann Gregor Mendel növényi hibridekkel kísérletezett, ám kísérletei eltértek elődjeitől, mivel pontos statisztikai mérésekkel értékelte kapott eredményeit. Mendel számos növényfajjal kísérletezett, ám az 1866-ban publikált dolgozatában a zöldborsóval végzett kísérleti eredményeit foglalta össze.A mendeli törvények, mind igazak azon gének öröklődésére, amelyek egymástól függetlenül öröklődnek: vagy különböző kromoszómákon helyezkednek el, vagy ugyanazon kromoszómán, de lényeges távolságra egymástól. Mendel munkásságának jelentőségére a XX. századig nem került sor.
1875-ben Ernst Haeckel először állította, hogy az öröklődésben a sejtmag fontos szerepet játszik. 1875-Herwig, 1879-Fol a tengeri sün peték fertilizációja kapcsán igazolták, hogy osztódáskor elengedhetetlen a sejtmag. Később Hammerling kísérletei bizonyítják a sejtmag jelentőségét az acetabularia moszatokon.
1888-ban megfigyelik a kromoszómákat mitózisban és meiózisban, majd Waldeyer nevezi el őket kromoszómának (festődő testecske).
Francis Galton 1889-ben összegzi munkáját, a genetikai elképzeléseiról. Galton megpróbálta bizonyítani, hogy a tehetség öröklődik (1869- Örökletes tehetség). Egy és kétpetéjű ikekvizsgálattal tesztelte hipotézislt a környezet hatásának felmérésére bizonyos kvantitatív tulajdonságok kialakításában. Ugyanebben az évben Altman bevezeti a nukleinsav fogalmát.
1900-at írunk abban az évben, amikor DeVries „újra felfedezi” Mendel törvényeit. Ez évben Correns is hasonló eredményekhez jut. A harmadik, aki szintén ugyanezen eredményeket kapta az Tschermak volt. Ezen munkák fényt derítettek Mendel munkásságának értékére. 1901-ben DeVries felismeri, hogy a gének megváltozhatnak, és elnevezi a jelenséget mutációnak. 1902-ben Boveri közölte tanulmányát mely szerint az egészséges embrió fejlődéséhez minden kromoszómára szükség van, mivel mindegyikük egyedi információt tartalmaz. McCluy felfedezi a szex kromoszómákat. William Bateson 1902-ben igazolta először Mendel törvényeinek érvényességét állatokon. 1906-ban a 3. növényhibridizációs konferencián, Londonban Bateson javasolja először e tudományág nevének a genetikát, mely az örökletesség és a változékonyságot tanulmányozza. 1909-ben Garrod az alkaptonuria, Farabee és Castle az albinizmus recesszív öröklődését mutatták ki.
1910-ben Thomas Morgan ecetmuslicákon végzett kísérletei meghatározóak voltak a genetika, mint különálló tudományág fejlődésében. E kísérletek az öröklődés kromoszómális elméletét bizonyítják, mely szerint a gének a kromoszómákon helyezkednek el. 1924-ben Bernstein leírja a vércsoportok genetikáját. 1927-ben Müller ecetmuslicákkal végzett kísérleteivel a spontán mutációk gyakoriságát bizonyítja és kimutatja az indukált röntgen mutációkat. 1928-ban kísértletekkel azonosítják és leírjék az eukromatin/ heterokromatin fogalmat. 1933-ban Haldene, Hogben és Fischer kidolgozza a Pedigree módszert (családfanalízis). 1941-ben Auerbach és Robson (1943 Oehlers) megfigyelik bizonyos kémiai vegyületek mutáció indukáló hatását. 1941-ben Beade és Tatum bizonyítják a neurospóra gombával azt az elméletet amely szerint 1 gén 1 enzimet kódol (később ezen elmélet megbukik).
1944-ben Avery, MacLeod és McCarty baktériumokkal végzett elegáns kísérletekkel bizonyítják, hogy a DNS az örökítő anyag.
1949-ben létrehozzák a Humán Genetika Amerikai Társaságát és az első humángenetikai újságot: Amerikai Humán Genetika Hírlap.
Megjelenik az első humángenetikai könyv: Curt Stern, A humán genetika elvei.
1953-ban James Watson, Francis Crick és Rosalind Franklin leírják a DNS dupla hélix szerkezetét, melyet két komplementer szál alkot, dezoxiribóz és monofoszfát molekulákkal. Wilson és Franklin megépítették a DNS modellt. 1955-ben Sanger meghatározta az aminosav szekvenciáját az inzulinnak. Ez az első bizonyíték a fehérjék elsődleges szerkezetére.
1956-ban Tjio és Levan meghatározták az emberi fajra jellemző kromoszómaszámot (2x23=46). Ugyancsak 1956-ban Kornberg kidolgozza a DNS szintézishez szükséges in vitro körülményeket. 1957-ben Crick és Gamow megfogalmazták a molekuláris biológia központi dogmáját: az egyirányú út a DNS, RNS és fehérjeszintézis között. Az DNS-ről az információ a messenger RNS irányába, majd erről a fehérje irányába történik. A dogma később módosult a reverz transzkriptáz enzim felfedezésével. Ez évben Ingram meghatározza a hemoglobin aminosav sorrendjét. 1958-ban Robert felfedezi a riboszómát, Dausset a humán HLA antigént és Sanford az egy-sejt klónozást dolgozza ki. 1959-ben kromoszómaszám változásokat fedeztek fel ismert kórképekben: 21-es triszómia-Down szindróma, 45, XO-Turner szindróma, 47, XXY-Klinefelter szindróma. 1960-ban leírják a DNS és fehérje közötti kapcsolatot, az mRNS-t. Szintén 1960-ban Krooth először mutatta ki emberi sejttenyészeten, hogy a galaktozémia egy öröklődő metabolikus anyagcserezavar. Patau leírja a 13-as és 18-as triszómiát. 1960-ban a humán kromoszómákhoz 1-22-ig terjedő sorszámot rendeltek és 7 csoportba osztották. Három évvel később a 7 csoportot A-G-ig terjedő betűjelzéssel látták el. 1966-ban Nirenberg, Mathaei és Ocho fényt derítettek a genetikai kódra. Kimutatták, hogy a 20 aminosavat 64 lehetséges triplett kombináció kódolja. 1970-ben felfedezik a reverz transzkriptázt.
1972-ben Paul Bergnek sikerült gént izolálni egy emberi rákbetegséget okozó majom vírusból. Ezt követően az izolált vírus DNS szekvenciát az E. coli lambda fágjába építette. Megalapozta a génsebészet első mérföldkövét. 1974-ben S. Anderson szekvenálja a gomba mitokondriális genomot. Létrehozzák az European Molecular Biology Laboratory (EMBL) hálózatot, amely a molekuláris biológia fejlesztését fogja szolgálni napjainkig. 1977-ben Sanger kidolgozza a DNS szekvenálás módszerét. Rekombináns DNS vizsgálatok rávilágíotanak arra, hogy tipikusan a gének nem folyamatos DNS kódoló részekből állnak, hanem nem kódoló (intron) részek vannak az információkódoló (exon) régiók között. Az exon elnevezést Gilbert vezette be 1978-ban. 1982-ben Klinger felfedezi a tumorszupreszor géneket. 1983 decemberében Mullis és Saiki kidolgozzák a polimeráz lánc-reakció (PCR) módszerét. Az 1980-as években végzett gombakísérletekkel mutatták ki, hogy a DNS-ben bekövetkező kettős szálú törések egy reparációs mechanizmust, ún. homológ rekombinációt indukálnak (a DNS kettős szálú törések egyik további alternatív reparációs mechanizmusa a nem-homológ vég-a-véghez illesztés, Non homologous end joining, NHEJ). 1986-ban klónoznak először humán géneket. 1987-ben DNS klónozás céljára használtak először élesztő mesterséges kromoszómákat. 1988-ban létrejön a National Center for Biotechnology Information (NCBI) központ. Szerepe a genomikus adatok vizsgálata és az információk gyors terjesztése. 1991-ben Craig Venter és Hamilton Smith kidolgozták a DNS szekvenálás „shotgun” stratégiáját.1989-ben egy meghatározott humán kromoszóma részét klónozták. 1990-ben kimutattak egy gént, amely meghatározóan fontos a mellrák kialakulásában. 1991-ben klónozták a cisztás fibrózis és Duchenne izomsorvadás génjét, majd 1993-ban a Huntington betegségért felelős gént. 1992-ben Mel Simon bevezeti a molekuláris klónozást bakteriális kromoszómákkal. 1994-ben elkészítették a magas felbontású humán genom fizikai térképét. 1996-ben megszületett Dolly, az első klónozott birka. 1999-ben szekvenálták az első humán kromoszómát, a 22. kromoszómát. 2000 júniusában a Humán Genom Projekt első adatai nyilvánosságra kerültek, majd 2001 februárjában publikálták az első összegzést, ezzel útjára bocsátva a genomiális érát.
Méhes Károly (1936-2007) Széchenyi díjas professzor, genetikus, gyermekgyógyász orvos és kutató megteremtette Pécsett a klinikai citogenetika és genetikai tanácsadás alapjait, illetve Magyarországon az elsők között indította útjára a humángenetikai kutatásokat. Az ő nevéhez fűződik az a megfigyelés, hogy a kromoszómák centromérái nem egyidőben válnak szét, a szétválás bizonyos szekvenciális rendet követ.
Czeizel Endre (1935-2015) Kennedy díjas, orvosgenetikus és epidemiológus professzor a genetika népszerűsítésében igen fontos szerepet válalt a XX. században. Nevéhez fűzhető legkiemelkedőbb tudományos eredménye: a folsav rendszeres, perikoncepcionális bevitele, lényegesen csökkenti a velőcsőzáródási rendellenességek (VZR) előfordulási gyakoriságát.
Gróf Festetics Imre
Továbbá 1820-ban Nasse megállapította, hogy a vérzékenység anyáról a fiú utódra öröklődik. A genetika atyjának tekintett Johann Gregor Mendel növényi hibridekkel kísérletezett, ám kísérletei eltértek elődjeitől, mivel pontos statisztikai mérésekkel értékelte kapott eredményeit. Mendel számos növényfajjal kísérletezett, ám az 1866-ban publikált dolgozatában a zöldborsóval végzett kísérleti eredményeit foglalta össze.A mendeli törvények, mind igazak azon gének öröklődésére, amelyek egymástól függetlenül öröklődnek: vagy különböző kromoszómákon helyezkednek el, vagy ugyanazon kromoszómán, de lényeges távolságra egymástól. Mendel munkásságának jelentőségére a XX. századig nem került sor.
1875-ben Ernst Haeckel először állította, hogy az öröklődésben a sejtmag fontos szerepet játszik. 1875-Herwig, 1879-Fol a tengeri sün peték fertilizációja kapcsán igazolták, hogy osztódáskor elengedhetetlen a sejtmag. Később Hammerling kísérletei bizonyítják a sejtmag jelentőségét az acetabularia moszatokon.
1888-ban megfigyelik a kromoszómákat mitózisban és meiózisban, majd Waldeyer nevezi el őket kromoszómának (festődő testecske).
Francis Galton 1889-ben összegzi munkáját, a genetikai elképzeléseiról. Galton megpróbálta bizonyítani, hogy a tehetség öröklődik (1869- Örökletes tehetség). Egy és kétpetéjű ikekvizsgálattal tesztelte hipotézislt a környezet hatásának felmérésére bizonyos kvantitatív tulajdonságok kialakításában. Ugyanebben az évben Altman bevezeti a nukleinsav fogalmát.
1900-at írunk abban az évben, amikor DeVries „újra felfedezi” Mendel törvényeit. Ez évben Correns is hasonló eredményekhez jut. A harmadik, aki szintén ugyanezen eredményeket kapta az Tschermak volt. Ezen munkák fényt derítettek Mendel munkásságának értékére. 1901-ben DeVries felismeri, hogy a gének megváltozhatnak, és elnevezi a jelenséget mutációnak. 1902-ben Boveri közölte tanulmányát mely szerint az egészséges embrió fejlődéséhez minden kromoszómára szükség van, mivel mindegyikük egyedi információt tartalmaz. McCluy felfedezi a szex kromoszómákat. William Bateson 1902-ben igazolta először Mendel törvényeinek érvényességét állatokon. 1906-ban a 3. növényhibridizációs konferencián, Londonban Bateson javasolja először e tudományág nevének a genetikát, mely az örökletesség és a változékonyságot tanulmányozza. 1909-ben Garrod az alkaptonuria, Farabee és Castle az albinizmus recesszív öröklődését mutatták ki.
1910-ben Thomas Morgan ecetmuslicákon végzett kísérletei meghatározóak voltak a genetika, mint különálló tudományág fejlődésében. E kísérletek az öröklődés kromoszómális elméletét bizonyítják, mely szerint a gének a kromoszómákon helyezkednek el. 1924-ben Bernstein leírja a vércsoportok genetikáját. 1927-ben Müller ecetmuslicákkal végzett kísérleteivel a spontán mutációk gyakoriságát bizonyítja és kimutatja az indukált röntgen mutációkat. 1928-ban kísértletekkel azonosítják és leírjék az eukromatin/ heterokromatin fogalmat. 1933-ban Haldene, Hogben és Fischer kidolgozza a Pedigree módszert (családfanalízis). 1941-ben Auerbach és Robson (1943 Oehlers) megfigyelik bizonyos kémiai vegyületek mutáció indukáló hatását. 1941-ben Beade és Tatum bizonyítják a neurospóra gombával azt az elméletet amely szerint 1 gén 1 enzimet kódol (később ezen elmélet megbukik).
1944-ben Avery, MacLeod és McCarty baktériumokkal végzett elegáns kísérletekkel bizonyítják, hogy a DNS az örökítő anyag.
1949-ben létrehozzák a Humán Genetika Amerikai Társaságát és az első humángenetikai újságot: Amerikai Humán Genetika Hírlap.
Megjelenik az első humángenetikai könyv: Curt Stern, A humán genetika elvei.
1953-ban James Watson, Francis Crick és Rosalind Franklin leírják a DNS dupla hélix szerkezetét, melyet két komplementer szál alkot, dezoxiribóz és monofoszfát molekulákkal. Wilson és Franklin megépítették a DNS modellt. 1955-ben Sanger meghatározta az aminosav szekvenciáját az inzulinnak. Ez az első bizonyíték a fehérjék elsődleges szerkezetére.
1956-ban Tjio és Levan meghatározták az emberi fajra jellemző kromoszómaszámot (2x23=46). Ugyancsak 1956-ban Kornberg kidolgozza a DNS szintézishez szükséges in vitro körülményeket. 1957-ben Crick és Gamow megfogalmazták a molekuláris biológia központi dogmáját: az egyirányú út a DNS, RNS és fehérjeszintézis között. Az DNS-ről az információ a messenger RNS irányába, majd erről a fehérje irányába történik. A dogma később módosult a reverz transzkriptáz enzim felfedezésével. Ez évben Ingram meghatározza a hemoglobin aminosav sorrendjét. 1958-ban Robert felfedezi a riboszómát, Dausset a humán HLA antigént és Sanford az egy-sejt klónozást dolgozza ki. 1959-ben kromoszómaszám változásokat fedeztek fel ismert kórképekben: 21-es triszómia-Down szindróma, 45, XO-Turner szindróma, 47, XXY-Klinefelter szindróma. 1960-ban leírják a DNS és fehérje közötti kapcsolatot, az mRNS-t. Szintén 1960-ban Krooth először mutatta ki emberi sejttenyészeten, hogy a galaktozémia egy öröklődő metabolikus anyagcserezavar. Patau leírja a 13-as és 18-as triszómiát. 1960-ban a humán kromoszómákhoz 1-22-ig terjedő sorszámot rendeltek és 7 csoportba osztották. Három évvel később a 7 csoportot A-G-ig terjedő betűjelzéssel látták el. 1966-ban Nirenberg, Mathaei és Ocho fényt derítettek a genetikai kódra. Kimutatták, hogy a 20 aminosavat 64 lehetséges triplett kombináció kódolja. 1970-ben felfedezik a reverz transzkriptázt.
1972-ben Paul Bergnek sikerült gént izolálni egy emberi rákbetegséget okozó majom vírusból. Ezt követően az izolált vírus DNS szekvenciát az E. coli lambda fágjába építette. Megalapozta a génsebészet első mérföldkövét. 1974-ben S. Anderson szekvenálja a gomba mitokondriális genomot. Létrehozzák az European Molecular Biology Laboratory (EMBL) hálózatot, amely a molekuláris biológia fejlesztését fogja szolgálni napjainkig. 1977-ben Sanger kidolgozza a DNS szekvenálás módszerét. Rekombináns DNS vizsgálatok rávilágíotanak arra, hogy tipikusan a gének nem folyamatos DNS kódoló részekből állnak, hanem nem kódoló (intron) részek vannak az információkódoló (exon) régiók között. Az exon elnevezést Gilbert vezette be 1978-ban. 1982-ben Klinger felfedezi a tumorszupreszor géneket. 1983 decemberében Mullis és Saiki kidolgozzák a polimeráz lánc-reakció (PCR) módszerét. Az 1980-as években végzett gombakísérletekkel mutatták ki, hogy a DNS-ben bekövetkező kettős szálú törések egy reparációs mechanizmust, ún. homológ rekombinációt indukálnak (a DNS kettős szálú törések egyik további alternatív reparációs mechanizmusa a nem-homológ vég-a-véghez illesztés, Non homologous end joining, NHEJ). 1986-ban klónoznak először humán géneket. 1987-ben DNS klónozás céljára használtak először élesztő mesterséges kromoszómákat. 1988-ban létrejön a National Center for Biotechnology Information (NCBI) központ. Szerepe a genomikus adatok vizsgálata és az információk gyors terjesztése. 1991-ben Craig Venter és Hamilton Smith kidolgozták a DNS szekvenálás „shotgun” stratégiáját.1989-ben egy meghatározott humán kromoszóma részét klónozták. 1990-ben kimutattak egy gént, amely meghatározóan fontos a mellrák kialakulásában. 1991-ben klónozták a cisztás fibrózis és Duchenne izomsorvadás génjét, majd 1993-ban a Huntington betegségért felelős gént. 1992-ben Mel Simon bevezeti a molekuláris klónozást bakteriális kromoszómákkal. 1994-ben elkészítették a magas felbontású humán genom fizikai térképét. 1996-ben megszületett Dolly, az első klónozott birka. 1999-ben szekvenálták az első humán kromoszómát, a 22. kromoszómát. 2000 júniusában a Humán Genom Projekt első adatai nyilvánosságra kerültek, majd 2001 februárjában publikálták az első összegzést, ezzel útjára bocsátva a genomiális érát.
Méhes Károly (1936-2007) Széchenyi díjas professzor, genetikus, gyermekgyógyász orvos és kutató megteremtette Pécsett a klinikai citogenetika és genetikai tanácsadás alapjait, illetve Magyarországon az elsők között indította útjára a humángenetikai kutatásokat. Az ő nevéhez fűződik az a megfigyelés, hogy a kromoszómák centromérái nem egyidőben válnak szét, a szétválás bizonyos szekvenciális rendet követ.
Czeizel Endre (1935-2015) Kennedy díjas, orvosgenetikus és epidemiológus professzor a genetika népszerűsítésében igen fontos szerepet válalt a XX. században. Nevéhez fűzhető legkiemelkedőbb tudományos eredménye: a folsav rendszeres, perikoncepcionális bevitele, lényegesen csökkenti a velőcsőzáródási rendellenességek (VZR) előfordulási gyakoriságát.

Az egy-sejt genomikai vizsgálatok hozta áttörés által elérhetővé vált egyidejűleg több ezer egyedi sejt genomszintű molekuláris feltérképezése, azaz egy adott egyedi sejt sejtmagjában található DNS molekulájának „elolvasása” (DNS bázissorrend feltérképezése – szekvenálása; DNS molekula metilációs mintázatának meghatározása, illetve a DNS molekulával asszociált hiszton fehérjék módosításainak azonosítása), a DNS molekuláról átíródó RNS molekulák mennyiségi meghatározása (RNS transzkriptom), valamint a minta RNS molekulák segítségével képződő fehérjék elemzése (fehérje proteom). Egy adott sejtből származó építőkövek és a szabályozó elemek részletes megismerése soha nem látott potenciált rejtő kulcselemek felderítésére kínál lehetőséget. Egy átláthatóbb, genetikai logikai szálakat összefűző útvonaltérképezést jelent az egy-sejt szintű funkcionális genomika. Az egészséges szervezet, egy adott szervén belül, illetve a különböző szervekben található sejtek precíz összehasonlítására nyújt lehetőséget. Egyrészt potenciálisan logaritmikus skálán növeli ismereteink az élettani folyamatok részletgazdagságáról, másrészt a különböző kórélettani interakciók molekuláris bölcsőjét fedezhetjük fel. Vizsgálhatjuk az egyedi sejtekben a különböző molekulák egymáshoz kialakított viszonyát, de talán a legérdekfeszítőbb egy sejtsor kontinuum felállítása és a vizsgált sejtek csoportosítása (klaszterezése) a lejátszó folyamatok szuperfelbontású megismeréséhez.
Hogyan is juthatunk egyedi sejtekhez? Mechanikus vagy enzimatikus disszociáció révén szuszpenzióban élő ép sejteket kell nyernünk. Ezt követően „halászni” kell az egyedi sejteket. Három megközelítés ismert az egyedi sejtek izolálására: 1. robotikai mikromanipuláció, 2. fluoreszcencia-alapú sejt válogatás, vagy 3. mikrofluidikai platformok alkalmazása. Ezen első lépés lényege a nukleinsavak (DNS, RNS) és fehérjék minél nagyobb mértékű megőrzése, az azt követő precíz vizsgálatok sikerességéhez. A második lépés egy adott sejtből a különböző molekula típusok elkülönítését jelenti. Egy fizikai szeparálással a DNS és RNS izolálása történik meg. Például mágneses gyöngyök felhasználásával megkötjük és elválasztjuk a poliadenilált (az mRNS molekulák 3’ végén található sok adenin) mRNS molekulákat a DNS-től. A sejteket buborékokba helyezve, sejtre vonatkozó egyedi azonosítót is társítunk, amely szelektíven megjelöli az általunk kívánt molekula csoportokat (DNS, RNS, fehérje).
Az egyik legkézenfekvőbb példája az immunrendszer vizsgálatához köthető. A környezeti hatásokra az immunsejtek az elsődleges válaszadók. Válaszuk során komplex, sejten belüli (intracelluláris) egymásra ható útvonalakat, és sejtek közötti (intercelluláris) interakciós hálózatokat módosítanak. Ezen tranziens válaszok az intra- és intercelluláris kommunikáció révén sejt-státusz megváltozásban nyilvánulnak meg, lehetőséget kínálva a rugalmas adaptációhoz. A csecsemőmirigy (tímusz) egy olyan elsődleges immunszerv, amely kritikus a saját sejtek iránti tolerancia és a funkcionális szerzett immunrendszer kialakításában. A sejtek közötti közeli kölcsönhatások a tímuszban található hámsejtek, vérsejtek és a fejlődő timociták között igen fontosnak bizonyul. Még az embrionális fejlődés során olyan gének fejeződnek ki ezen sejtekben, amelyeket felnőttkori autoimmunfolyamatokkal hoztak összefüggésbe. Egy-sejt transzkriptomikai kísérlet világított rá először, hogy az autoimmun folyamatok első lépései még a magzati állapotban debütálnak. A szabályozó funkcióval ellátott regulatorikus T-sejtek döntő többsége a tímuszból ered. Ezek a sejtek domináns-negatív módon szabályozzák az immunrendszer számos pillérét, erősítve a perifériás toleranciát a saját sejtekkel, a szimbiotikus kommenzális baktériumokkal és a magzati antigénekkel szemben. Továbbá szabályozzák a szöveti homeosztázist és a steril gyulladás mértékét. Az egy-sejt transzkriptomikai adatok segítségével bizonyították a regulatorikus T-sejtek kontinuum állapotát. Ezen kontinuum három gravitációs állapot körül mozog: 1 nyugvó, 1 naív és memória, és 1 aktivált pólus körül. Meglepően magas konzerváltságra mutat a 3 gravitációs állapot az egér és humán sejtek között. Ezen állapotok felderítése új gyógyterápiás mechanizmusok és célpontokra világíthat az autoimmun betegségek kapcsán.
Hogy miért is aktuális az egy-sejt funkcionális genomika? Tekintsük át a történelmi idővonalát, és önmagunk válaszolunk a kérdésre. Az első egy-sejt transzkriptomikai vizsgálatot (RNS molekulák mennyiségi meghatározása) Tang és mtsai 2009 végezték egér sejteken. Elméletileg egy adott sejtben egy adott RNS molekula 1-100,000 példányban (kópiában) található, de átlagosan kevesebb mint 100 kópiában van jelen egy adott transzkriptum. Négy év múlva, azaz 2013-ban Han és mtsai először írtak le olyan módszert, amely során egy sejtből DNS-t és RNS-t egyaránt vizsgáltak. További három évet kellet várni arra míg integráltan és egyidejűleg transzkriptomikai és epigenomikai (DNS metilációs) vizsgálatot egy-sejtből végezhettek a kutatók. Ennek fényében 2016-ban Hou és mtsai ún. scTrio-seq technikát dolgozott ki, az egy-sejt genomikai DNS, epigenom és transzkriptomikai elemzésre. Az epigenomikai aspektusok (citozin metiláció 5mC, hidroximetiláció 5hmC, illetve formilcitozin 5fC) rövid és hosszútávon szabályozhatják a gének kifejeződését (expreszióját). Az 5mC transzkripciós gátlással (represszióval), míg az 5hmC és 5fC transzkripciós aktivációval asszociálhatók. Egy évvel később, 2017-ben, oligonukleotid-jelölt antitesteket felhasználva sikerült integrálni a sejtfehérjék és transzkriptomikai expressziós méréseket, egy hatékony egy-sejt kiolvasásban. Egy sejt funkcionális identitását leginkább a sejtben található fehérjék határozzák meg. Gyakorlatilag a fehérjék és a fehérjék poszttranszlációs módosítása révén a sejtek képesek érzékelni és válaszolni virtuálisan minden külső (extrinszikus) és belső (intrinszikus) stimulusra. Továbbá, egy-sejt tömegspektrometriai módszerről is beszámoltak 2017-ben, amely bővíti az egy-sejt módszertani repertoárt a sejt proteom felmérésével. Végül, az egy-sejt metabolom taglalása maradt hátra. A metabolom a teljes molekuláris palettára kiterjedő fogalom, magába foglalja mindazon alacsony molekulasúlyú metabolitokat, amelyeket egy adott sejt termel. A fentiek taglalásából egyértelműen következtethető, hogy az igen nagy generált adatmennyiség értékeléséhez egy nemzetközi platformra van szükség. Ennek megfelelően még 2016-ban létrehozták a Humán Sejt Atlasz (The Human Cell Atlas) platformot, melynek célja részletesen jellemezni minden sejttípust és sejtállapotot a humán szervezetben. A különböző egy-sejt térképező technikák alkalmazásával ún. multi-omikai profilokat állíthatunk fel minden egyes vizsgált sejtről és teljesíthetővé válik a Humán Sejt Atlasz célkitűzése. A jelenleg elérhető, 2018 első felében létrehozott Sejt Atlasz Kereső (Cell Atlas Search) online felület kiegészíti a kapott adatok feldolgozását. Referencia expressziós profilokat tartalmaz, illetve az új, eddig még ismeretlen humán sejttípusok azonosítását elősegítő felületként is működik. Mindezen adatok tükrében egy nagyon pozitív irány felé mutató, zendülő lendülettel haladó genomikának vagyunk tanúi. Az egy-sejt funkcionális genomikai módszertan iránytűként mutat utat az orvosbiológiai kutatásokban és inspirálja az új generációs terápiás eljárások fejlesztését a gyulladás, autoimmunitás és rákos megbetegedések területén.

Dezoxiribonukleinsav, azaz DNS szintje
Minden ember, minden magvas sejtjében megtalálható a DNS. Két ember DNS-e 99,5%-ban azonos, ami azt jelenti, hogy átlagosan 15 millió bázispár különbség kölcsönzi a genom szintű egyediséget két ember között.
Ribonukleinsav, azaz RNS szintje
A DNS-ről átíródó RNS molekulák összességét transzkriptomnak nevezzük. A transzkriptomnak döntően két fontos szerepe van: templátként szolgálnak a fehérjék szintéziséhez (mRNS molekulák), illetve szabályozó és kulcsfontosságú szereppel bírnak a különböző sejtben zajló folyamatokban (rRNS, tRNS, miRNS, lncRNS, siRNS)
Fehérjék szintje
A sejtek citoplazmájában az érett mRNS molekulákból a transzlációs folyamat során fehérjék szintetizálódnak. A humán setekben leírt fehérjék száma 73112 (2018. 07. 26. adatok/ uniprot.org)
Metabolitok szintje
A humán metabolom nemzetközi adatbázisa szerint (4. verzió, 2018. 07. 26./ hmdb.ca) 114100 metabolitot azonosítottak a humán szervezetben.